截至北京时间3月20日19时,中国以外已有170多个国家和地区出现新冠肺炎疫情,国外的新冠肺炎累计确诊病例超过17万例。在中国疫情得到控制、国外疫情日益严峻的时候,口罩生意成了跨境卖家的“香馍馍”。
商务部早已澄清中国不禁止医用口罩出口,但是对于卖家来说,关于口罩出口依然有诸多问题。我们将目前卖家最关注的问题和参考答案整理如下,供各位参考。
能卖口罩的电商渠道
虽然亚马逊、ebay等主流平台对口罩加强管控和限制,但并不是完全禁止销售,卖家在满足平台要求的情况下依然可以销售。
速卖通:产品合法合规,按照类目要求发布,卖家可申请;
阿里巴巴国际站:产品合法合规,按照类目要求发布,卖家可申请;
Wish:保证产品质量,确保产品符合政策规定及各国法律要求,卖家可申请;
敦煌网:日用防护口罩、劳保口罩,按照类目要求发布,卖家可申请;
real.de:CE认证和符合医用资质,最好海外发货,卖家可申请;
Mercado Libre:标题不能提及疫情,店铺不能只卖口罩,卖家可申请;
Gmarket&Auction:可以售卖口罩,但不能捆绑销售或作为赠品进行销售。
Tophatter:对口罩销售不设限!3月16日起Tophatter还带来为期两周的限时推广活动。3月16日至31日期间入驻的新卖家,凡上架防疫用品或日用消耗品等产品,可都能获得快速审批,由客户经理1对1跟进,指导销售。
Joom:目前没有出台口罩相关新规,只要商户满足出口资质,就可以正常售卖。
Kilimall:目前可销售口罩,不过平台同时启动了最严格的商品质量监控、检测。医用物品如N95口罩、医用一次性口罩、防护眼镜、防护服等商品等属于特殊品类,需要相关的资质才可进行销售,并且需要上传至平台指定品类。
Starday:口罩,护目镜、防护服、消毒液等物资都可以通过Starday平台出口日本。有关出口的防疫物资审核标准,请咨询平台招商经理。
独立站也是目前口罩出口的一个渠道,通常是自发货的形式,走快递小批外发,比如Shopify。但是不能有价格虚高或欺诈问题存在,违反了Shopify AUP政策,平台也会采取关停账户的措施。
此外,一些海外论坛也可以销售口罩,比如Craigslist(北美)、Kijiji(北美)、Gumtree(英国、澳洲),需要卖家去上面发帖,但是覆盖范围不大,可作为曝光渠道的补充。
出口企业的资质要求
口罩出口对生产销售单位、境内发货人,除满足国内生产、市场流通资质需求外,中国海关无特殊资质要求。
国内出口贸易企业需具备的资质和材料:
①营业执照(经营范围有相关经营内容)。
②企业生产许可证(生产企业)。
③产品检验报告(生产企业)。
④医疗器械注册证(非医用不需要)。
⑤产品说明书(跟着产品提供)、标签(随附产品提供)。
⑥产品批次/号(外包装)。
⑦产品质量安全书或合格证(跟着产品提供)。
⑧产品样品图片及外包装图片。
⑨贸易公司须取得海关收发货人注册备案。
国内出口口罩生产企业资质证明:
生产个人防护或者工业用非医疗器械管理的普通口罩,有进出口权的企业,可自行直接出口。
生产属于医疗器械管理的口罩用于出口,中国海关不需要企业提供相关资质证明文件,但一般进口国会要求生产企业提供产品三证,以证明该进口的商品在中国已合法上市,具体如下:
①营业执照(经营范围包含有医疗器械相关,非医疗级别的物品不需要)。
②医疗器械产品备案证或者注册证。
③厂家检测报告。
生产企业有进出口权,可以自行出口,如没有进出口权,可以通过外贸代理进行出口销售。
内贸企业做出口需要取得的基本资质:
①向市场监管部门取得营业执照,增加经营范围“货物进出口、技术进出口、代理进出口”。
②向商务部门取得进出口权,可直接在商务部业务系统统一平台(http://iecms.mofcom.gov.cn/)申请,网上提交材料。
③向外汇管理局申请取得开设外汇账户许可。
④办理进出口货物收发货人海关注册登记。
03
PART
出口申报要求
①商品归类:除特殊情况外,绝大部分口罩应归入税号63079010(3月20日海关税则号更新,增加了6307900010口罩专用税号)
②检验检疫:口罩为非法检产品,申报时检验检疫项目无需填报。根据我国政府与相关国家签订的政府间检验协议,对出口伊朗等少数几个国家的产品需按规定进行装运前检验。
③关税征免:如出口物资为贸易性质,征免性质申报一般征税,征免方式申报照章征税;如为捐赠性质,境内发货人为贸易代理商、慈善机构等,征免性质可不填,征免方式申报全免。
④禁限管理:目前商务部未对口罩设置贸易管制要求,中国海关也无针对防护物资的监管证件口岸验核要求。
⑤申报规范:按照规范申报要求填写商品名称、成分含量;如物资非中国生产,原产国按照实际生产国填写。
关税问题
美国:美国企业可申请排除口罩进口加征关税,但是目前只有少数企业获准豁免。详见美国贸易代表办公室网站https://ustr.gov/。
韩国:据韩联社报道,韩国企划财政部3月17日通过《关于适用关税配额的规定》修订案,决定针对进口口罩和口罩核心原材料暂停征收关税,零关税措施从本月18日起实施,截至6月30日。
各国口罩准入条件
【美国】
必要资料:提单,箱单,发票。
个人防护口罩:必须取得美国 NIOSH检测认证,即National Institute for Occupational Safety and Health美国国家职业安全卫生研究所认证。
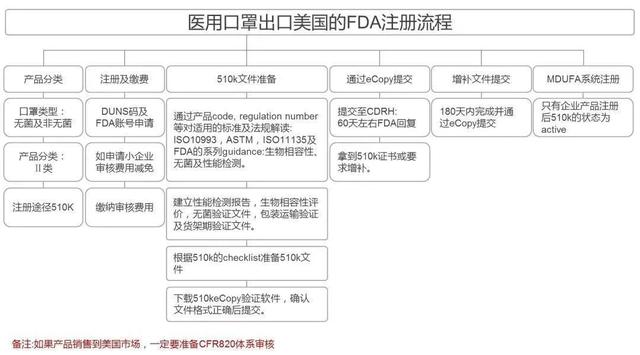
医用口罩:须取得美国FDA注册许可。

【欧盟】
必要资料:提单,箱单,发票。
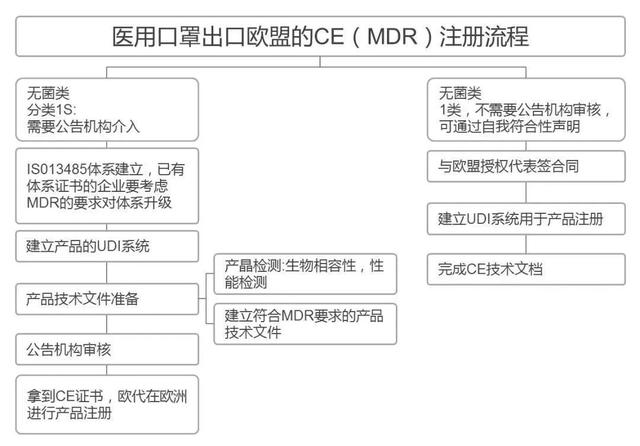
个人防护口罩:个人防护口罩的欧盟标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别。所有出口欧盟的口罩必须获得CE认证证书。CE认证是欧盟实行的强制性产品安全认证制度,目的是为了保障欧盟国家人民的生命财产安全。

医用口罩:医用口罩对应的欧盟标准是EN14683。产品在欧盟销售需要出具欧盟自由销售证书 Free Sale Certificate,有了CE标志并进行了相关指令中要求的欧盟注册后,中国的制造商出口欧盟不需要自由销售证书。
根据最新消息,因疫情防控加大了对口罩、手套、眼罩、防护衣等防疫用品的需求,日前,欧盟施行紧急预案开启防疫物资绿色通道。
据了解,需要公告机构认证的防疫用品(例如说一类灭菌的医用口罩),在原本的法规下需要好几个月才能拿到证书,在此之前还需要通过产品安全和性能测试,并且要申请MDR。
但是在疫情期间,只要产品处于正在进行符合性评估的过程中,就可以在没有CE标志的情况下先行进入欧盟市场。
【日本】
必要资料:提单,箱单,发票,日本国外的制造商必须向PMDA注册制造商信息。
口罩包装要求
包装上印有ウィルスカット(中文翻译:病毒拦截)99%的字样
PFE:0.1um微粒子颗粒过滤效率
BFE:细菌过滤率
VFE:病毒过滤率

口罩品质标准
1. 医用防护口罩:符合中国GB 19083-2010 强制性标准,过滤效率≥95%(使用非油性颗粒物测试)。
2. N95口罩:美国NIOSH认证,非油性颗粒物过滤效率≥95%。
3. KN95口罩:符合中国GB 2626 强制性标准,非油性颗粒物过滤效率≥95%。
【韩国】
必要资料:提单,箱单,发票,韩国进口商营业执照。
个人防护口罩标准:KF (Korean filter) 系列分为KF80、KF94、KF99

执行标准规范:MFDS Notice No. 2015-69
韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr。
【澳大利亚】
必要资料:提单,箱单,发票。
须通过澳洲的TGA注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸保护装置标准。
TGA 是Therapeutic Goods Administration的简写,全称是治疗商品管理局,它是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。
各国注册、认证简要办理流程
▎美国NIOSH认证
需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。
NIOSH将其认证的防颗粒物口罩分为9类,具体的测试则由NIOSH下属的NPPTL (National Personal Protective Technology Laboratory)实验室操作。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。
▎美国FDA注册

▎欧盟CE注册
▎日本PMDA注册
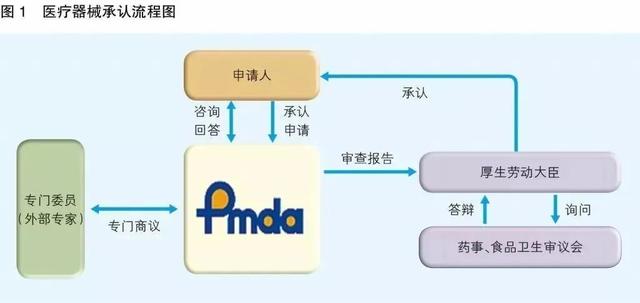
1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方);
2. 制造商向PMDA注册工厂;
3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书;
4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。
▎韩国KFDA注册
韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为:
1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方);
2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书;
3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试;
4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批;
5. 支付申请费用;
6. 注册文件整改,注册批准;
7. 指定韩国代理商和经销商,产品销售。
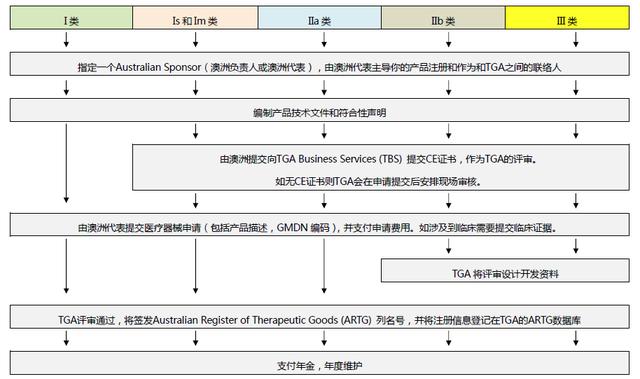
▎澳大利亚TGA注册
依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。如果已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。
各国口罩技术标准对比
各国口罩技术标准对比(供生产企业参考)
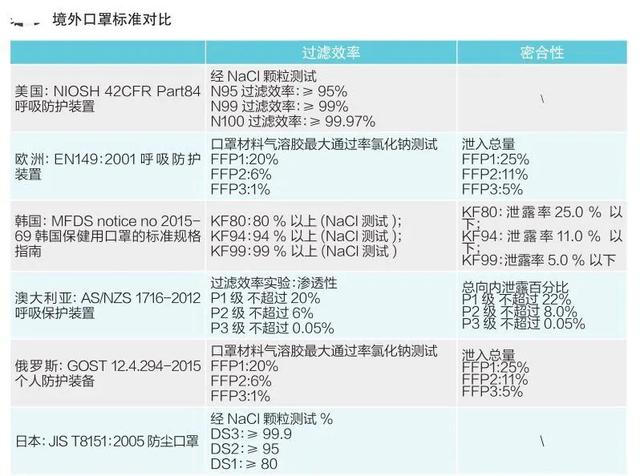
*以上技术标准如有动态调整,以相关标准管理机构官方发布为准。